Lipidos
8.1 Da una breve definiciòn de cada uno de los siguientes términos:
a) Ácidos grasos polisaturados: es un ácido graso que contiene más de un doble enlace
b) Micela: es una estructura esférica relativamente pequeña en las que intervienen desde docenas hasta millares de moléculas ordenadas de modo que sus regiones hidrofóbicas se agregan en el interior y los grupos de cabeza hidrofilitos están en la superficie de contacto del agua.
c) Bicapa lipidica: es un agregado lipidico en donde se combinan 2 monocapas lipidicas formando una hoja bidimensional, esta se da cuando las àreas transversales del grupo de la cabeza y las cadenas laterales son similares.
d) Inositol: vitamina B8, es necesaria para la formación correcta de las membranas celulares.
e) Gangliósidos: son los esfingolipidos más complejos, contienen 2 cabezas polares muy grandes formadas por varias unidades glucídicas. Constituyen el 6% de los lípidos de la materia gris.
f) Enfermedad de Tay-Sachs: es la acumulación de un gangliósido especifico en el cerebro y en el bazo, debido a la falta de enzima lisosómica hexosamidasa A, enzima degradante de hidroliza normalmente un residuo de N-acetil-D-galactosamina y uno de D-galactosa en la cabeza polar del gangliosido. Como resultado se acumula el gangliósido parcialmente degradado produciendo degeneraciòn del sistema nervioso. los sintomas son retraso progresivo del crecimiento, parálisis, ceguera y muerte a los 3 o 4 años.
g) Ateroesclerosis: es la acumulación patológica de colesterol en los vasos sanguineos, comunmente en arterias, dando como resultado la obstrucción de los vasos sanguineos, está ligada a niveles altos de olesterol en sangre.
h) Isoprenos:
i) Eicosanos:
j) Plastoquinona: transporta electrones en los cloroplastos.
k) Acido graso omega-3: son ácidos grasos poliinsaturados que se encuentran en alta proporción en los tejidos de ciertos pescados y en algunos vegetales como la semmilla de lino, cañamones y nueces.
l) Jabones: glicerol y sales Na o K de los ácidos grasos, obetenidos por el calentamiento de grasas animales con NaOH o KOH, poseen la capacidad de solubilizar o dispersar materiales insolubles en agua mediante la formación micelas.
m) Triacilglicerol: lípidos más sensillos obtenidos a partir de ácidos grasos, llamados trigliceridos, grasas o grasas neutras.
n) Grasas saturadas: son aquellos que presentan enlaces simples en la cadena hidrocarbonada, se dispone en el espacio en zig-zag
.o) Prostanglandinas: contienen un anillo de 5 átomos de carbono que originalmente formaban parte de la cadena de ácido araquidónico.
p)
q) Ácidos grasos trans: tipo de grasa que se encuentra principalmente en alimentos industrializados que han sido sometidos a hidrogenación como la margarina o al hornearlo como los pasteles entre otros.
r) Hidrogenación parcial:
s) Feromonas
t) Enzimas COX:
u) NSAIDs Non-steroidal antiinflamatorio grugs:
8.2 ¿Cual de las siguientes molèculas están compuestas en la familia de los lípidos?a)l-decanolb) Alaninac) Fructosad) Ácido Palmíticoe) Trimiristinf) Glicerolg) Adeninah) B-carotenei) Aspartamej) Insulinak) Ubiquitinal) Etanolm)Estimasterol
8.3 Resuelve la nomenclatura escrita de cada una de las siguientes ácidos grasos.
a) 17:2 D 9, 12b) 21:4 D 1, 14, 17
8.4 Resuelve la nomenclatura taquigrafica para cada uno de los siguientes cidos grasos:a) 10:1 D 4 CH3CH2CH2CH=CH(CH2)5COOHb) 18:2 D 9, 12 CH3(CH2)5CH=CHCH2CH=CH(CH)5COOHc) 18:3 D 9, 12, 15 CH3(CH2)5CH=CHCH2CH=CHCH2CH=CHCH2CH2COOH
8.5 Algunos científicos y médicos ahora recomiendan a la ingestión de aceite de pescado por reducir el riesgo de problema cardíaco. Los dos componentes de ácidos principales grasos en una cápsula de aceite de pescado son debajo. Dibuje las estructuras de estos compuestos.
8, 11, a) Acido eicosapentaenoico 20:5 D 5, 14,17CH3 CH2 CH=CHCH2 CH=CHCH2 CH=CHCH2 CH=CHCH2 CH=CH(CH2)3 COOHb) Acido dodehexanoico 22:6 D 4, 7, 10, 13, 16, 19CH3 CH2 CH=CHCH2 CH=CHCH2 CH=CHCH2 CH=CHCH2 CH=CHCH2 CH=CH(CH2)2 COOH
8.7 Explique por qué los jabones en soluciones acuosas se reúnen en estructuras de micelas.En la formación de una micela de jabón en agua, las moléculas de jabón (una sal de sodio o potasio de un ácido graso) se enlazan entre sí por sus extremos hidrófobos que corresponden a las cadenas hidrocarbonadas, mientras que sus extremos hidrófilos, aquellos que llevan los grupos carboxilo, ionizados negativamente por pérdida de un ion sodio o potasio, se repelen entre sí. De esta manera las cadenas no polares del jabón se ocultan al agua, mientras que los grupos carboxilo, cargados negativamente, se hallan expuestos a la misma.
8.8 ¿Cómo funcionan las sales biliares en la digestión de grasas?Compuestos antipáticos sintetizados en el hígado a partir de colesterol, se almacenan en la vesícula biliar y se liberan al intestino delgado después de la ingestión de una comida que contenga grasas, actúan como detergentes biológicos, convirtiendo las grasas de la dieta en micelas mixtas de ácidos biliares y triacilgliceroles, la formación de micelas incrementa la fracción de moléculas de lípido accesibles a la acción de las lipasas hidrosolubles en el intestino, que convierte los triacligliceroles en monoacilgliceroles y diacligliceroles, ácidos grasos libres y glicerol. Estos productos de la acción de las lipasas se difunden hacia el interior de la mucosa intestinal, donde se convierte de nuevo a triacilgliceroles y se empaquetan junto con el colesterol de la dieta y proteínas específicas para formar agregados lipoproteícos denominados quilomicrones.
8.9 Escriba una reacción o describa la acción de cada enzima.
a) Lipasa. Las lipasas en el intestino colaboran en la digestión y absorción de las grasas de la dieta. Catalizan la hidrólisis enzimatica de los triacilgliceroles
.b) Prostaglandina sintetasa. Desencadenan la contracción de la musculatura lisa; fiebre; inflamación.c) Lipoxigenasa.La acción de la 15-lipoxigenasa sobre el ácido araquidónico genera dos metabolitos terminales, la Lipoxina A (LXA) y Lipoxina B (LXB). Ambos metabolitos tienen acción inductora de la degranulación de los neutrófilos, siendo LXB dos órdenes de magnitud más potente que LXA. También se ha demostrado que inhiben la reacción citotóxica de los linfocitos T. Killer, sin afectar su unión a las células blanco. Finalmente se les ha descrito un discreto efecto constrictor del músculo liso bronquial.
8.10 ¿Por qué algunos aceites de cocina, canola y el aceite de oliva, se hacen rancios más pronto que mantequillas sólidas?Porque la mantequilla sólida esta parcialmente hidrogenizada y resiste mas tiempo que los aceites.8.11 Los lípidos de la membrana, tienen una cola polar delantera y no polar. Asigna estas dos regiones en cada una de las moléculas siguientes.a) Colesterol. Cabeza polar (grupo hidroxilo) C-3b) fosfatidilcolinac) esfingomielinad) cerebrósidose) b- sitosterol
8.12 ¿Cuales son moléculas importantes en el metabolismo de energía?
a) triacilgliceridos. Si
b) terpenos. No
c) glicerofosfolipidos. Si
d) cerebrósidos. Si
sábado, 27 de octubre de 2007
carbohidratos cuestionario biokimik 1
7.24
 7.19
7.19


7.21
 7.19
7.19
7.2:

7.20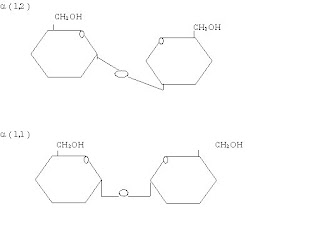

7.1.-DEFINIR LOS SIGUIENTES TERMINOS CON 25 PALABRAS O MENOS:
Monosacáridos: Los monosacáridos o azúcares simples son los glúcidos más sencillos, conteniendo de tres a seis átomos de carbono. Su fórmula empírica es (CH2O)n donde n ≥ 3. Se nombran haciendo referencia al número de carbonos (3-6), terminado en el sufijo osa. La cadena carbonada de los monosacáridos no está ramificada y todos los átomos de carbono menos uno contienen un grupo alcohol (-OH). El átomo de carbono restante tiene unido un grupo carbonilo (C=O). Si este grupo carbonilo está en el extremo de la cadena se trata de un grupo aldehído (-CHO) y el monosacárido recibe el nombre de aldosa.
Aldosa: Una aldosa es un monosacárido (cierto tipo de azúcares) conteniendo un grupo aldehído por molécula.Su fórmula química de la forma genérica CnH2nOn (n>=3). Los carbonos se van numerando desde el grupo aldehído (el más oxidado de la molécula) hacia abajo.
Gliceraldehido: El gliceraldehído es una aldotriosa que posee dos isómeros ópticos ya que tiene un carbono asimétrico - en la figura: C* -.
Centroquiral: Se llama centro quiral o asimétrico a un átomo unido a cuatro sustituyentes diferentes. Una molécula que posee un centro quiral tiene una imagen especular no superponible con ella, denominada enantiómero.
Diasteromero: clase de estereoisómeros que no tienen una imagen especular entre ellos, es decir, no son enantiómeros. Entre ellas pueden tener diversas características físicas y diferente reactividad.
Ceto hexona: en una primera aproximación, son polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Si se presenta de forma similar a una cetona, diremos es una cetohexosa.
Furanosa: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico, que puede tener 5 o 6 átomos. Si tiene 5 átomos, la forma se llama furanosa,
Hemiacetal cíclico: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico
Centro Anumerico:
Azúcar reductor: son aquellos que, como la glucosa, fructosa, lactosa y maltosa presentan un carbono libre en su estructura y pueden reducir, en determinadas condiciones, a las sales cúpricas.
Quintina: es un polisacárido que forma el recubrimiento muy resistente que poseen la mayoría de los artrópodos. Es el segundo polímero natural más abundante después de la celulosa. Es usada como agente floculante para tratamiento de agua, como agente para curar heridas, como espesante y estabilizador en alimentos y medicamentos, como resina intercambiadora de iones. Es altamente insoluble en agua y en solventes orgánicos debido a los enlaces de hidrógeno que presenta la molécula.
Glucocidos: Enlace Glicocidico: es el enlace para unir monosacáridos con el fin de formar disacáridos o polisacáridos
Intolerancia a l a lactosa: es una afectación de la mucosa intestinal con imposibilidad para digerir la lactosa (azúcar de la leche) debido a una deficiencia de una enzima llamada lactasa.
Homo polisacárido: compuesto de un único tipo de monómero
Granulo de glucógeno: es una sola molécula, consistente en una cadena muy ramificada, rodeada por las enzimas que participan en su formación y degradación. A los gránulos aislados se les denomina glucógeno . Cuando forman acúmulos a modo de roseta, se le llama glucógeno .
Lectina: Proteína que se une fuertemente a un azúcar específico. Muchas lectinas derivan de semillas vegetales ya menudo se utilizan como reactivos de afinidad para purificar glucoproteínas o para detectarlas sobre la superficie de las células.
Glicoproteína: son moléculas compuestas por una proteína unida a uno o varios hidratos de carbono, simples o compuestos. Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membrana plasmática.
Acido sialico: es el ácido N-acetil-neuramínico presente en los gangliósidos
7.2DIBUJE TODA LA FAMILIA DE LAS TRIOSAS (TRES CARBONOS)
GLICERALALDEHIDO:
7.3CUANTOS CENTROS QUIRALES PRESENTAN CADA UNO DE LOS SIGUIENTES MONOSACARIDOS:
Dihidroxiacetona: No tiene centro quiral
Ribosa:tiene 3 centros quirales
Eritrulosa:tiene 1 centro quiral
Glucosamina:4 centros quirales
Fructuosa:tiene 3 centros quirales
Sedohectulosa:tiene 4 centros quirales
2-desoxirribosa:tiene 2 centros quirales
N-acetil glucosalina:5 centros
Acido ciánico:1 centro quiral
7.4 UTILIZA EL METODO DE LA PROYECCION DE FISCHER AL DRENAJE DE LOS MONOSACARIDOS SIGUIENTES:
D-GLICERALDEHIDO
L-RIBOSA
D-MANOSA
7.5 DUBUJA EL METODO DE PROYECCION DE FISCHER DE D-Y L-ENANTIOMEROS DE LA GLUCOSA
7.6 DE LOS SIGUIENTES CARBOHIDRATOS CUALES DARIAN PRUEBA POSITIVA DEL REACTIVO DE FEHLING:
a)glucosa: la prueba da positivo, porque el OH del carbono carbonilo está libre, por lo que reacciona con el sulfato de cobre del Fehling (azúl), reduciendo a óxido de cobre (rojo ladrillo).
b)ribosa 5-fosfato: la prueba da positivo
c) trealosa.- la prueba da positiva
d) lactosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa.
e) sacarosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
f) maltosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa y lactosa
7.7 ESTUDIA LAS ESTRUCTURAS DE LOS COMPONENTES MENCIONADOS Y EN LISTAR TODOS LOS GRUPOS ORGANICOS FUNCIONALES PRESENTES EN CADA MOLECULA
A)GLICERALDHEIDO.-Contiene grupo funcional hidroxilo y aldheido
B)GLUCOSA(FISCHER).-Contiene grupo funcional hidroxilo y aldheido
C)GLUCOSA(HAWORTH).-Contiene grupo funcional hidroxilo
D)N-ACETILGLUCOSAMINA.-Grupo funcional cetona y amino
E)ACIDO GALACTURONICO.-Grupo funcional carboxilo
7.8 escriba el nombre y dibuje la estructura de un disacárido o el polisacárido que tiene al menos uno de los tipos siguientes de o-glycosidic bonds.use cualquier monosacárido de construye el oligosacarido.
A)B(1,4).-CELULOSA,QUINTINA
B)L(1,4).-MALTOSA AMILOSA,AMINOPECTINA,GLUCOGENO,CELULOSA
C)L(1,6).-ISOMALTOSA,AMINOPECTINA,DEXTRANA
7.9 CUAL DE LOS SIGUIENTES AMINOACIDOS RESIDUALES ES UNA PROTEINA PODRIAN SER UN POTENCIO DE SITIO DE GLUCOSILACION POR SEÑALAMIENTO DE UNA UNIDAD OLISACARIDO
A)GLICINA.-No tiene grupo OH
B)4 HIDROXIPROLINA.-Si tiene grupo OH
C)ASPAROGINA.-No tiene grupo OH
D)VALINA.-No tiene grupo OH
E)SERINA.-Si tiene OH
F)5 HIDROXILISINA.-Si tiene OH
G)TREONINA.-SI tiene OH
H)CISTEINA.-No tiene OH
7.10 NOMBRE DEL GRUPO FUNCIONAL DE LAS PROTEINAS PUEDEN SERVIR COMO UN SITIO DE GLUCOSILACIONGRUPO CRABOXILICO (acido carboxilico)
7.11 CUANTOS CARBONOS ANOMERICOS TIENEN LOS SIGUIENTES MONOSACARIDOS
GLUCOSA.-4 carbonos anomericos
RIBOSA.-3 carbonos anomericos
GALACTOSA.-4 crabonos anomericos
FRUCTOSA.-3 carbonos anomericos
SEDOHEPTULOSA.-4 carbonos anomericos
7.12 DEFINE EL GRUPO FUNCIONAL QUE PRESENTA CADA CARBON ATOMO DE LA B-D FRUCTOPIRANOSA
C1.-OH ION HIDROXILO
C2.-OH ION HIDROXILO
C3.-OH ION HIDROXILO
7.13NOMBRE UNA BIOMOLECULA ESPECIFICA QUE SEA MIEMBRO DE CAD UNA DE LAS SIGUIENTES CLASES
A.)MONOSACARIDOS.-HEXOSAS,GALACTOSA,MANOSA
B)DISACRAIDO.-GLUCOPIRANOSA,LACTOSA,SACAROSA
C)POLISACARIDO.-ALMIDO,ACIDO POLIGALACTURONICO
D)HOMOPOLISACARIDO.-ALMIDON CELULOSA
E)HETEROPOLISACARIDO.-GLICOSAMINOGLICANO,PEPTIDOGLUCANO
7.14 COMPARAR LAS AMILOSA (ALMIDON) Y EL GLUCOGENO EN TERMINOS DE LAS SIGUIENTES CARACTERISTICAS:
ALMIDON
GLUCOGENO
TIPO DE ORGANISMO DONDE SE SINTETIZA
Se obtiene exclusivamente de los vegetales que lo sintetizan a partir del dióxido de carbono que toman de la atmósfera y del agua que toman del suelo. .- en los cereales y vegetales.
seres humanos, en el hígado, el corazón y los músculos
La síntesis de glucógeno a partir de glucosa se llama glucogénesis y se produce gracias al enzima glucógeno sintetizas. seres humanos, en el hígado, el corazón y los músculos
FUNCION BIOLOGICA
Reserva energética Proporciona gran parte de la energía que consumimos los humanos por vía de los alimentos.
Material de reserva energetica
TIPO DE SACARIDOS
Mezcla de dos de la amilosa y la amilo pectina.
polisacárido
α-glucosas
ESTRUCTURA QUIMICA
UNION ENTRE LAS UNIDADES
Unidas entre ellas por enlaces 1-4 lo que da lugar a una cadena lineal.
se une a la siguiente cadena mediante un enlace α-1,6-glucosídico
7.15 NOMBRA 5 MONOSACARIDOS COMUNES EN GLUCOPROTEINAS
1.GALACTOSA
2.-GALACTOSA
3.-MANOSA
4.-XILOSA
7.16 DESCRIBE BREVEMENTE DOS FUNCIONES DE LA GLUCOPROTEINAS:
Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membranas plasmáticas.
Reconocimiento celular
Los tipos sanguíneos dependen del tipo de glicoproteína que contienen la membrana de los eritrocitos; el tipo de sangre A tiene como oligosacárido una cadena de N-acetilgalactosamina, mientras que el tipo B tiene una cadena de galactosa, de tal modo que, el tipo AB presenta los 2 tipos de glicoproteínas y el tipo O carece de ambos. Para determinar el tipo sanguíneo se usan antisueros, que contienen anticuerpos que reconocen determinado tipo de glicoproteína (el antisuero A reconoce la glicoproteína A). El conocimiento del tipo sanguíneo es importante para hacer transfusiones y evitar la formación de coágulos que provocan infartos y trombosis cerebrales mortales
SIRVEN COMO ESTRUCTURAS
7.17 CUAL ESLA RELACION ENTRE CADA PARA DE COMPUESTOS QUE FIGURAN A CONTINUACION
a)Gliceraldehido contra dihidroxicetona pares aldosa cetosa
b)Glucosa contra fructosa anómeros
c)Glucosa contra manosa epímeros
d)Triosa contra eritrosa enantiómeros
e)2 glucosamina contra 2 galactosamina anómeros
f)alfa glucosa contra beta glucosa anómeros
g)d glucosa contra l glucosa enantiómeros
h)d glucosa contra d galactosa anómeros
7.18 PORQUE UN GLICERALDEHIDO Y UNA ERITROSA NO ESTAN EN UNA ESTRUCTURA CICLICA HEMIACETAL Y PORQUE ES UNA RIBOSA SI
Porque forma una estructura ciclica hemiacetal se requieren mas de 4 carbonos,para formar el ciclo y el gliceraldehido solo tiene 3 carbonos
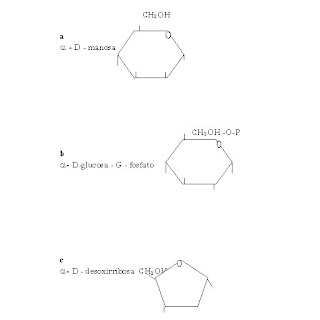
7.19 use el fórmula de proyección haworth para dibujar cada uno de los monosacáridos siguientes
CH2OH
a
a - D - manosa
CH2OH -O-P
b
a - D-glucosa - G - fosfato
c
a - D - desoxirribosa CH2OH
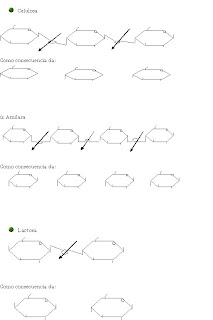
7.20 El disacárido trealosa es el mayor componente de la hemolinfa, la circulación de fluidos en insectos, y está abundante en las setas, hongos y bacterias. Es un componente únicamente 2 unidades con enlaces alfa, alfa (1,2) glucosaza.
Monosacáridos: Los monosacáridos o azúcares simples son los glúcidos más sencillos, conteniendo de tres a seis átomos de carbono. Su fórmula empírica es (CH2O)n donde n ≥ 3. Se nombran haciendo referencia al número de carbonos (3-6), terminado en el sufijo osa. La cadena carbonada de los monosacáridos no está ramificada y todos los átomos de carbono menos uno contienen un grupo alcohol (-OH). El átomo de carbono restante tiene unido un grupo carbonilo (C=O). Si este grupo carbonilo está en el extremo de la cadena se trata de un grupo aldehído (-CHO) y el monosacárido recibe el nombre de aldosa.
Aldosa: Una aldosa es un monosacárido (cierto tipo de azúcares) conteniendo un grupo aldehído por molécula.Su fórmula química de la forma genérica CnH2nOn (n>=3). Los carbonos se van numerando desde el grupo aldehído (el más oxidado de la molécula) hacia abajo.
Gliceraldehido: El gliceraldehído es una aldotriosa que posee dos isómeros ópticos ya que tiene un carbono asimétrico - en la figura: C* -.
Centroquiral: Se llama centro quiral o asimétrico a un átomo unido a cuatro sustituyentes diferentes. Una molécula que posee un centro quiral tiene una imagen especular no superponible con ella, denominada enantiómero.
Diasteromero: clase de estereoisómeros que no tienen una imagen especular entre ellos, es decir, no son enantiómeros. Entre ellas pueden tener diversas características físicas y diferente reactividad.
Ceto hexona: en una primera aproximación, son polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Si se presenta de forma similar a una cetona, diremos es una cetohexosa.
Furanosa: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico, que puede tener 5 o 6 átomos. Si tiene 5 átomos, la forma se llama furanosa,
Hemiacetal cíclico: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico
Centro Anumerico:
Azúcar reductor: son aquellos que, como la glucosa, fructosa, lactosa y maltosa presentan un carbono libre en su estructura y pueden reducir, en determinadas condiciones, a las sales cúpricas.
Quintina: es un polisacárido que forma el recubrimiento muy resistente que poseen la mayoría de los artrópodos. Es el segundo polímero natural más abundante después de la celulosa. Es usada como agente floculante para tratamiento de agua, como agente para curar heridas, como espesante y estabilizador en alimentos y medicamentos, como resina intercambiadora de iones. Es altamente insoluble en agua y en solventes orgánicos debido a los enlaces de hidrógeno que presenta la molécula.
Glucocidos: Enlace Glicocidico: es el enlace para unir monosacáridos con el fin de formar disacáridos o polisacáridos
Intolerancia a l a lactosa: es una afectación de la mucosa intestinal con imposibilidad para digerir la lactosa (azúcar de la leche) debido a una deficiencia de una enzima llamada lactasa.
Homo polisacárido: compuesto de un único tipo de monómero
Granulo de glucógeno: es una sola molécula, consistente en una cadena muy ramificada, rodeada por las enzimas que participan en su formación y degradación. A los gránulos aislados se les denomina glucógeno . Cuando forman acúmulos a modo de roseta, se le llama glucógeno .
Lectina: Proteína que se une fuertemente a un azúcar específico. Muchas lectinas derivan de semillas vegetales ya menudo se utilizan como reactivos de afinidad para purificar glucoproteínas o para detectarlas sobre la superficie de las células.
Glicoproteína: son moléculas compuestas por una proteína unida a uno o varios hidratos de carbono, simples o compuestos. Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membrana plasmática.
Acido sialico: es el ácido N-acetil-neuramínico presente en los gangliósidos
7.2DIBUJE TODA LA FAMILIA DE LAS TRIOSAS (TRES CARBONOS)
GLICERALALDEHIDO:
7.3CUANTOS CENTROS QUIRALES PRESENTAN CADA UNO DE LOS SIGUIENTES MONOSACARIDOS:
Dihidroxiacetona: No tiene centro quiral
Ribosa:tiene 3 centros quirales
Eritrulosa:tiene 1 centro quiral
Glucosamina:4 centros quirales
Fructuosa:tiene 3 centros quirales
Sedohectulosa:tiene 4 centros quirales
2-desoxirribosa:tiene 2 centros quirales
N-acetil glucosalina:5 centros
Acido ciánico:1 centro quiral
7.4 UTILIZA EL METODO DE LA PROYECCION DE FISCHER AL DRENAJE DE LOS MONOSACARIDOS SIGUIENTES:
D-GLICERALDEHIDO
L-RIBOSA
D-MANOSA
7.5 DUBUJA EL METODO DE PROYECCION DE FISCHER DE D-Y L-ENANTIOMEROS DE LA GLUCOSA
7.6 DE LOS SIGUIENTES CARBOHIDRATOS CUALES DARIAN PRUEBA POSITIVA DEL REACTIVO DE FEHLING:
a)glucosa: la prueba da positivo, porque el OH del carbono carbonilo está libre, por lo que reacciona con el sulfato de cobre del Fehling (azúl), reduciendo a óxido de cobre (rojo ladrillo).
b)ribosa 5-fosfato: la prueba da positivo
c) trealosa.- la prueba da positiva
d) lactosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa.
e) sacarosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
f) maltosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa y lactosa
7.7 ESTUDIA LAS ESTRUCTURAS DE LOS COMPONENTES MENCIONADOS Y EN LISTAR TODOS LOS GRUPOS ORGANICOS FUNCIONALES PRESENTES EN CADA MOLECULA
A)GLICERALDHEIDO.-Contiene grupo funcional hidroxilo y aldheido
B)GLUCOSA(FISCHER).-Contiene grupo funcional hidroxilo y aldheido
C)GLUCOSA(HAWORTH).-Contiene grupo funcional hidroxilo
D)N-ACETILGLUCOSAMINA.-Grupo funcional cetona y amino
E)ACIDO GALACTURONICO.-Grupo funcional carboxilo
7.8 escriba el nombre y dibuje la estructura de un disacárido o el polisacárido que tiene al menos uno de los tipos siguientes de o-glycosidic bonds.use cualquier monosacárido de construye el oligosacarido.
A)B(1,4).-CELULOSA,QUINTINA
B)L(1,4).-MALTOSA AMILOSA,AMINOPECTINA,GLUCOGENO,CELULOSA
C)L(1,6).-ISOMALTOSA,AMINOPECTINA,DEXTRANA
7.9 CUAL DE LOS SIGUIENTES AMINOACIDOS RESIDUALES ES UNA PROTEINA PODRIAN SER UN POTENCIO DE SITIO DE GLUCOSILACION POR SEÑALAMIENTO DE UNA UNIDAD OLISACARIDO
A)GLICINA.-No tiene grupo OH
B)4 HIDROXIPROLINA.-Si tiene grupo OH
C)ASPAROGINA.-No tiene grupo OH
D)VALINA.-No tiene grupo OH
E)SERINA.-Si tiene OH
F)5 HIDROXILISINA.-Si tiene OH
G)TREONINA.-SI tiene OH
H)CISTEINA.-No tiene OH
7.10 NOMBRE DEL GRUPO FUNCIONAL DE LAS PROTEINAS PUEDEN SERVIR COMO UN SITIO DE GLUCOSILACIONGRUPO CRABOXILICO (acido carboxilico)
7.11 CUANTOS CARBONOS ANOMERICOS TIENEN LOS SIGUIENTES MONOSACARIDOS
GLUCOSA.-4 carbonos anomericos
RIBOSA.-3 carbonos anomericos
GALACTOSA.-4 crabonos anomericos
FRUCTOSA.-3 carbonos anomericos
SEDOHEPTULOSA.-4 carbonos anomericos
7.12 DEFINE EL GRUPO FUNCIONAL QUE PRESENTA CADA CARBON ATOMO DE LA B-D FRUCTOPIRANOSA
C1.-OH ION HIDROXILO
C2.-OH ION HIDROXILO
C3.-OH ION HIDROXILO
7.13NOMBRE UNA BIOMOLECULA ESPECIFICA QUE SEA MIEMBRO DE CAD UNA DE LAS SIGUIENTES CLASES
A.)MONOSACARIDOS.-HEXOSAS,GALACTOSA,MANOSA
B)DISACRAIDO.-GLUCOPIRANOSA,LACTOSA,SACAROSA
C)POLISACARIDO.-ALMIDO,ACIDO POLIGALACTURONICO
D)HOMOPOLISACARIDO.-ALMIDON CELULOSA
E)HETEROPOLISACARIDO.-GLICOSAMINOGLICANO,PEPTIDOGLUCANO
7.14 COMPARAR LAS AMILOSA (ALMIDON) Y EL GLUCOGENO EN TERMINOS DE LAS SIGUIENTES CARACTERISTICAS:
ALMIDON
GLUCOGENO
TIPO DE ORGANISMO DONDE SE SINTETIZA
Se obtiene exclusivamente de los vegetales que lo sintetizan a partir del dióxido de carbono que toman de la atmósfera y del agua que toman del suelo. .- en los cereales y vegetales.
seres humanos, en el hígado, el corazón y los músculos
La síntesis de glucógeno a partir de glucosa se llama glucogénesis y se produce gracias al enzima glucógeno sintetizas. seres humanos, en el hígado, el corazón y los músculos
FUNCION BIOLOGICA
Reserva energética Proporciona gran parte de la energía que consumimos los humanos por vía de los alimentos.
Material de reserva energetica
TIPO DE SACARIDOS
Mezcla de dos de la amilosa y la amilo pectina.
polisacárido
α-glucosas
ESTRUCTURA QUIMICA
UNION ENTRE LAS UNIDADES
Unidas entre ellas por enlaces 1-4 lo que da lugar a una cadena lineal.
se une a la siguiente cadena mediante un enlace α-1,6-glucosídico
7.15 NOMBRA 5 MONOSACARIDOS COMUNES EN GLUCOPROTEINAS
1.GALACTOSA
2.-GALACTOSA
3.-MANOSA
4.-XILOSA
7.16 DESCRIBE BREVEMENTE DOS FUNCIONES DE LA GLUCOPROTEINAS:
Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membranas plasmáticas.
Reconocimiento celular
Los tipos sanguíneos dependen del tipo de glicoproteína que contienen la membrana de los eritrocitos; el tipo de sangre A tiene como oligosacárido una cadena de N-acetilgalactosamina, mientras que el tipo B tiene una cadena de galactosa, de tal modo que, el tipo AB presenta los 2 tipos de glicoproteínas y el tipo O carece de ambos. Para determinar el tipo sanguíneo se usan antisueros, que contienen anticuerpos que reconocen determinado tipo de glicoproteína (el antisuero A reconoce la glicoproteína A). El conocimiento del tipo sanguíneo es importante para hacer transfusiones y evitar la formación de coágulos que provocan infartos y trombosis cerebrales mortales
SIRVEN COMO ESTRUCTURAS
7.17 CUAL ESLA RELACION ENTRE CADA PARA DE COMPUESTOS QUE FIGURAN A CONTINUACION
a)Gliceraldehido contra dihidroxicetona pares aldosa cetosa
b)Glucosa contra fructosa anómeros
c)Glucosa contra manosa epímeros
d)Triosa contra eritrosa enantiómeros
e)2 glucosamina contra 2 galactosamina anómeros
f)alfa glucosa contra beta glucosa anómeros
g)d glucosa contra l glucosa enantiómeros
h)d glucosa contra d galactosa anómeros
7.18 PORQUE UN GLICERALDEHIDO Y UNA ERITROSA NO ESTAN EN UNA ESTRUCTURA CICLICA HEMIACETAL Y PORQUE ES UNA RIBOSA SI
Porque forma una estructura ciclica hemiacetal se requieren mas de 4 carbonos,para formar el ciclo y el gliceraldehido solo tiene 3 carbonos
7.19 use el fórmula de proyección haworth para dibujar cada uno de los monosacáridos siguientes
CH2OH
a
a - D - manosa
CH2OH -O-P
b
a - D-glucosa - G - fosfato
c
a - D - desoxirribosa CH2OH
7.20 El disacárido trealosa es el mayor componente de la hemolinfa, la circulación de fluidos en insectos, y está abundante en las setas, hongos y bacterias. Es un componente únicamente 2 unidades con enlaces alfa, alfa (1,2) glucosaza.
¿Es un carbohidrato reductor?
Parte de 2 glucosas reductoras dulces por lo tanto se consigue de un disacárido no reductor, con un bajo poder edulcorante.
Dibuja esta estructura
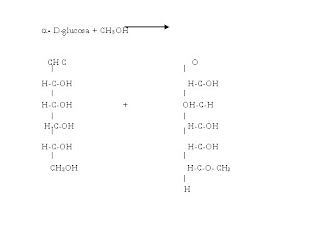
7.21 Completa las siguientes reacciones de carbohidratos y dibuja las estructuras de los productos orgánicos
a - D-glucosa + CH3OH
7.22 CUAL ES EL COMPONENTE MAS SOLUBLE EN AGUA
1-HEXANOL O D-GLUCOSA
EL 1 HEXANAL NO PUEDE SER PORQUE ES HIDROFOBICO Y ES INCAPAZ DE EXPERIMENTAR INTERACCIONES ENERGETICAMENTE FAVORABLES CON LAS MOLECULAS DE AGUA Y DE HECHO LAS IONES DE SOLUTO DISUELTOS EN EL AGUA INTERFIEREN CON LOS PUENTES DE HIDROGENO.
7.23 ¿POR QUÉ LA REACCIÓN DE LA FIGURA 7.11 ES CLASIFICADA COMO UNA REACCIÓN DE OXIDACTION-REDUCCIÓN?
7.24 ESCRIBE LA REACCION CATALIZADORA DE CADA UNA DE LAS SIGUIENTES ENZIMAS
7.24 Escribe la reacción catalizadora de cada una de las siguientes enzimas.
7.25 ¿Por qué TODOS LOS MONOSACARIDOS Y DISACARIDOS SON SOLUBLES EN AGUA?
DEBIDO ALA POLARIDAD QUE PRESENTAN.Y COMO POLARIDAD ESTA HACIA LOS EXTREMOS PUEDENNREALIZARSE ENLACES COVALENTES
DISACARIDOS SOLUBLES EN AGUA YLIGERAMENTE SOLUBLES EN ALCOHOL Y ETER.LA FRUCTOSA ES EL MONOSACRIDO MÁS SOLUBLE SEGUIDO DE LA SACAROSA Y LA GLUCOSA MIENTRAS QUE LA LACTOSA ES EL MENOS SOLUBLE POR LO QUE EL CRISTALIZA MÁS FACILMENTE.
7.26ESCRIBE LAS ESTRUCTURAS QUE MUESTRAN LA QUIMICA DE CADA UNA DE LAS SIGUIENTES REACCIONES:
A)D-GLUCOSA + GLUCOSA -------GLUCOSA-1-FOSFATO + ADP
B)LACTOSA+H2O ----------GALACTOSA +GLUCOSA
C)GLICERALDHEIDO -3-FOSFATO-----DIHIDROXIACETONA FOSFATO
D)GLUCOSA+NADH+H+---------SORBITOL + NAD+
7.27 USE UNO DE LOS TÉRMINOS(LAS CONDICIONES) DEBAJO PARA DESCRIBIR LA QUÍMICA QUE OCURRE EN PARTES A-D
Oxido reduccion d)glucosa+nadh+h+---------sorbitol + nad+
Hidrólisis b)lactosa+h2o ----------galactosa +glucosa
Fosforizacion a)d-glucosa + glucosa -------glucosa-1-fosfato + adp
Isomeracion c)gliceraldheido -3-fosfato-----dihidroxiacetona fosfato
7.28 CATALOGUE UN NOMBRE COMÚN PARA UNA ENZIMA QUE CATALIZARÍA CADA UNA DE LAS REACCIONES EN EL PROBLEMA 7.26
A.FOSFORILAXIA
B.LACTASA
C.INVERTAZA
D.OXIDO-REDUCCION
7.29 SUGIERA UN TRATAMIENTO PARA INTOLERANCIA A LA LACTOSA
TOMAR LECHE DESLACTOSADA
7.30ESCRIBE LA ESTRUCTURA D-GALACTURONICO ACIDO DEACUERDO ALAS SIGUIENTES CONDICIONES
A)PH 1.0
B)PH 7.0
C)PH 12.0
7.31 el cacahuete lectina ata expresamente al disacarido galactosa la n-acetilgalactosamina. Los dos monosacáridos son unidos por una B (1,3)obligación glucosilacion. Dibuje la estructura de este disacárido
Parte de 2 glucosas reductoras dulces por lo tanto se consigue de un disacárido no reductor, con un bajo poder edulcorante.
Dibuja esta estructura
7.21 Completa las siguientes reacciones de carbohidratos y dibuja las estructuras de los productos orgánicos
a - D-glucosa + CH3OH
7.22 CUAL ES EL COMPONENTE MAS SOLUBLE EN AGUA
1-HEXANOL O D-GLUCOSA
EL 1 HEXANAL NO PUEDE SER PORQUE ES HIDROFOBICO Y ES INCAPAZ DE EXPERIMENTAR INTERACCIONES ENERGETICAMENTE FAVORABLES CON LAS MOLECULAS DE AGUA Y DE HECHO LAS IONES DE SOLUTO DISUELTOS EN EL AGUA INTERFIEREN CON LOS PUENTES DE HIDROGENO.
7.23 ¿POR QUÉ LA REACCIÓN DE LA FIGURA 7.11 ES CLASIFICADA COMO UNA REACCIÓN DE OXIDACTION-REDUCCIÓN?
7.24 ESCRIBE LA REACCION CATALIZADORA DE CADA UNA DE LAS SIGUIENTES ENZIMAS
7.24 Escribe la reacción catalizadora de cada una de las siguientes enzimas.
7.25 ¿Por qué TODOS LOS MONOSACARIDOS Y DISACARIDOS SON SOLUBLES EN AGUA?
DEBIDO ALA POLARIDAD QUE PRESENTAN.Y COMO POLARIDAD ESTA HACIA LOS EXTREMOS PUEDENNREALIZARSE ENLACES COVALENTES
DISACARIDOS SOLUBLES EN AGUA YLIGERAMENTE SOLUBLES EN ALCOHOL Y ETER.LA FRUCTOSA ES EL MONOSACRIDO MÁS SOLUBLE SEGUIDO DE LA SACAROSA Y LA GLUCOSA MIENTRAS QUE LA LACTOSA ES EL MENOS SOLUBLE POR LO QUE EL CRISTALIZA MÁS FACILMENTE.
7.26ESCRIBE LAS ESTRUCTURAS QUE MUESTRAN LA QUIMICA DE CADA UNA DE LAS SIGUIENTES REACCIONES:
A)D-GLUCOSA + GLUCOSA -------GLUCOSA-1-FOSFATO + ADP
B)LACTOSA+H2O ----------GALACTOSA +GLUCOSA
C)GLICERALDHEIDO -3-FOSFATO-----DIHIDROXIACETONA FOSFATO
D)GLUCOSA+NADH+H+---------SORBITOL + NAD+
7.27 USE UNO DE LOS TÉRMINOS(LAS CONDICIONES) DEBAJO PARA DESCRIBIR LA QUÍMICA QUE OCURRE EN PARTES A-D
Oxido reduccion d)glucosa+nadh+h+---------sorbitol + nad+
Hidrólisis b)lactosa+h2o ----------galactosa +glucosa
Fosforizacion a)d-glucosa + glucosa -------glucosa-1-fosfato + adp
Isomeracion c)gliceraldheido -3-fosfato-----dihidroxiacetona fosfato
7.28 CATALOGUE UN NOMBRE COMÚN PARA UNA ENZIMA QUE CATALIZARÍA CADA UNA DE LAS REACCIONES EN EL PROBLEMA 7.26
A.FOSFORILAXIA
B.LACTASA
C.INVERTAZA
D.OXIDO-REDUCCION
7.29 SUGIERA UN TRATAMIENTO PARA INTOLERANCIA A LA LACTOSA
TOMAR LECHE DESLACTOSADA
7.30ESCRIBE LA ESTRUCTURA D-GALACTURONICO ACIDO DEACUERDO ALAS SIGUIENTES CONDICIONES
A)PH 1.0
B)PH 7.0
C)PH 12.0
7.31 el cacahuete lectina ata expresamente al disacarido galactosa la n-acetilgalactosamina. Los dos monosacáridos son unidos por una B (1,3)obligación glucosilacion. Dibuje la estructura de este disacárido
jueves, 4 de octubre de 2007
6-ANOMEROS, EPIMEROS, ENANTIOMEROS O PARES DE ALDOSAS CETOSAS
a)Gliceraldehido vs dihidroxicetona pares aldosa cetosa
b)Glucosa vs fructosa anómeros
c)Glucosa vs manosa epímeros
d)Triosa vs eritrosa enantiómeros
e)2 glucosamina vs 2 galactosamina anómeros
f)alfa glucosa vs beta glucosa anómeros
g)d glucosa vs l glucosa enantiómeros
h)d glucosa vs d galactosa anómeros
b)Glucosa vs fructosa anómeros
c)Glucosa vs manosa epímeros
d)Triosa vs eritrosa enantiómeros
e)2 glucosamina vs 2 galactosamina anómeros
f)alfa glucosa vs beta glucosa anómeros
g)d glucosa vs l glucosa enantiómeros
h)d glucosa vs d galactosa anómeros
5- COMPARAR LA AMILOSA (ALMIDON) Y EL GLUCOGENO EN TERMINOS DE LAS SIGUIENTES CARACTERISTICAS:
TIPO DE ORGANISMO DONDE SE SINTETIZA
ALMIDON: se obtiene exclusivamente de los vegetales que lo sintetizan a partir del dióxido de carbono que toman de la atmósfera y del agua que toman del suelo.
GLUCOGENO: La síntesis de glucógeno a partir de glucosa se llama glucogénesis y se produce gracias al enzima glucógeno sintetasas.
FUNCION BIOLOGICA
ALMIDON: proporciona gran parte de la energía que consumimos los humanos por vía de los alimentos.
GLUCOGENO: Material de reserva
TIPO DE SACARIDOS
ALMIDON: mezcla de dos, la amilosa y la amilopectina
GLUCOGENO: α-glucosas
UNION ENTRE LAS UNIDADES
ALMIDON: unidas entre ellas por enlaces a 1-4 lo que da lugar a una cadena lineal.
GLUCOGENO: se une a la siguiente cadena mediante un enlace α-1,6-glucosídico
TIPO DE RAMIFICACION
ALMIDON: aparecen cada 20 o 30 glucosas
GLUCOGENO: Ramificadas de glucosa solubles en agua.
ALMIDON: se obtiene exclusivamente de los vegetales que lo sintetizan a partir del dióxido de carbono que toman de la atmósfera y del agua que toman del suelo.
GLUCOGENO: La síntesis de glucógeno a partir de glucosa se llama glucogénesis y se produce gracias al enzima glucógeno sintetasas.
FUNCION BIOLOGICA
ALMIDON: proporciona gran parte de la energía que consumimos los humanos por vía de los alimentos.
GLUCOGENO: Material de reserva
TIPO DE SACARIDOS
ALMIDON: mezcla de dos, la amilosa y la amilopectina
GLUCOGENO: α-glucosas
UNION ENTRE LAS UNIDADES
ALMIDON: unidas entre ellas por enlaces a 1-4 lo que da lugar a una cadena lineal.
GLUCOGENO: se une a la siguiente cadena mediante un enlace α-1,6-glucosídico
TIPO DE RAMIFICACION
ALMIDON: aparecen cada 20 o 30 glucosas
GLUCOGENO: Ramificadas de glucosa solubles en agua.
4-DE LOS SIGUIENTES CARBOHIDRATOS CUALES DARIAN PRUEBA POSITIVA EN EL REACTIVO DE FEHLING:
a) glucosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, por lo que reacciona con el sulfato de cobre del Fehling (azúl), reduciendo a óxido de cobre (rojo ladrillo).
b) ribosa 5 fosfato.- la prueba da positivo
c) trealosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
d) lactosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa.
e) sacarosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
f) maltosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa y lactosa.
b) ribosa 5 fosfato.- la prueba da positivo
c) trealosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
d) lactosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa.
e) sacarosa.- la prueba da negativo, porque en este disacárido ambos grupos OH de los carbonos carbonilos participan en el enlace o-glucosídico.
f) maltosa.- la prueba da positivo, porque el OH del carbono carbonilo está libre, al igual que la glucosa y lactosa.
1-DEFINIR LO SIGUIENTES TERMINOS CON 25 OMANOS PALABRAS
Monosacárido: son azucares sencillos son derivados de aldehídos o cetonas de cadena lineal y alcoholes polihidroxilicos que contienen tres átomos de carbono.
Aldosa: es un monosacárido (cierto tipo de azúcares) conteniendo un grupo aldehído por molécula.
Glicer aldehído: es una aldotriosa que posee dos isómeros ópticos ya que tiene un carbono asimétrico.
Centro quiral: Se obtiene cuando un átomo central y otros cuatro átomos o grupos de átomos distintos se unen adoptando una geometría molecular tetraédrica.
Diasteromeros: clase de estereoisómeros que no tienen una imagen especular entre ellos, es decir, no son enantiómeros. Entre ellas pueden tener diversas características físicas y diferente reactividad.
Cetohexosas: en una primera aproximación, son polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Si se presenta de forma similar a una cetona, diremos es una cetohexosa.
Furanosa: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico, que puede tener 5 o 6 átomos. Si tiene 5 átomos, la forma se llama furanosa,
Hemiacetal cíclico: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico
Azúcar reductor: son aquellos que, como la glucosa, fructosa, lactosa y maltosa presentan un carbono libre en su estructura y pueden reducir, en determinadas condiciones, a las sales cúpricas.
Quitina: es un polisacárido que forma el recubrimiento muy resistente que poseen la mayoría de los artrópodos. Es el segundo polímero natural más abundante después de la celulosa. Es usada como agente floculante para tratamiento de agua, como agente para curar heridas, como espesante y estabilizador en alimentos y medicamentos, como resina intercambiadora de iones. Es altamente insoluble en agua y en solventes orgánicos debido a los enlaces de hidrógeno que presenta la molécula.
Enlace Glicocidico: es el enlace para unir monosacáridos con el fin de formar disacáridos o polisacáridos
Intolerancia a la lactosa: es una afectación de la mucosa intestinal con imposibilidad para digerir la lactosa (azúcar de la leche) debido a una deficiencia de una enzima llamada lactasa.
Homo polisacárido: compuesto de un único tipo de monómero
Granulo de glucógeno: es una sola molécula, consistente en una cadena muy ramificada, rodeada por las enzimas que participan en su formación y degradación. A los gránulos aislados se les denomina glucógeno b . Cuando forman acúmulos a modo de roseta, se le llama glucógeno a .
Lectina: Proteína que se une fuertemente a un azúcar específico. Muchas lectinas derivan de semillas vegetales ya menudo se utilizan como reactivos de afinidad para purificar glucoproteínas o para detectarlas sobre la superficie de las células.
Glicoproteína: son moléculas compuestas por una proteína unida a uno o varios hidratos de carbono, simples o compuestos. Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membrana plasmática.
Acido sialico: es el ácido N-acetil-neuramínico presente en los gangliósidos
Aldosa: es un monosacárido (cierto tipo de azúcares) conteniendo un grupo aldehído por molécula.
Glicer aldehído: es una aldotriosa que posee dos isómeros ópticos ya que tiene un carbono asimétrico.
Centro quiral: Se obtiene cuando un átomo central y otros cuatro átomos o grupos de átomos distintos se unen adoptando una geometría molecular tetraédrica.
Diasteromeros: clase de estereoisómeros que no tienen una imagen especular entre ellos, es decir, no son enantiómeros. Entre ellas pueden tener diversas características físicas y diferente reactividad.
Cetohexosas: en una primera aproximación, son polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Si se presenta de forma similar a una cetona, diremos es una cetohexosa.
Furanosa: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico, que puede tener 5 o 6 átomos. Si tiene 5 átomos, la forma se llama furanosa,
Hemiacetal cíclico: los monosacáridos de cinco o más carbonos se encuentran fundamentalmente en forma cerrada, es decir, con el grupo carboxilo formando parte de un anillo hemiacetálico
Azúcar reductor: son aquellos que, como la glucosa, fructosa, lactosa y maltosa presentan un carbono libre en su estructura y pueden reducir, en determinadas condiciones, a las sales cúpricas.
Quitina: es un polisacárido que forma el recubrimiento muy resistente que poseen la mayoría de los artrópodos. Es el segundo polímero natural más abundante después de la celulosa. Es usada como agente floculante para tratamiento de agua, como agente para curar heridas, como espesante y estabilizador en alimentos y medicamentos, como resina intercambiadora de iones. Es altamente insoluble en agua y en solventes orgánicos debido a los enlaces de hidrógeno que presenta la molécula.
Enlace Glicocidico: es el enlace para unir monosacáridos con el fin de formar disacáridos o polisacáridos
Intolerancia a la lactosa: es una afectación de la mucosa intestinal con imposibilidad para digerir la lactosa (azúcar de la leche) debido a una deficiencia de una enzima llamada lactasa.
Homo polisacárido: compuesto de un único tipo de monómero
Granulo de glucógeno: es una sola molécula, consistente en una cadena muy ramificada, rodeada por las enzimas que participan en su formación y degradación. A los gránulos aislados se les denomina glucógeno b . Cuando forman acúmulos a modo de roseta, se le llama glucógeno a .
Lectina: Proteína que se une fuertemente a un azúcar específico. Muchas lectinas derivan de semillas vegetales ya menudo se utilizan como reactivos de afinidad para purificar glucoproteínas o para detectarlas sobre la superficie de las células.
Glicoproteína: son moléculas compuestas por una proteína unida a uno o varios hidratos de carbono, simples o compuestos. Tienen entre otras funciones el reconocimiento celular cuando están presentes en la superficie de la membrana plasmática.
Acido sialico: es el ácido N-acetil-neuramínico presente en los gangliósidos
sábado, 22 de septiembre de 2007
carbohidratos
Hidrato de carbono
Glucosa - forma dextrógira
Fructosa - forma dextrógira
Ribosa - forma furanosa
Los hidratos de carbono son una clase básica de compuestos químicos en bioquímica. Son la forma biológica primaria de almacenamiento o consumo de energía; otras formas son las grasas y las proteínas.
El término hidrato de carbono es poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino de átomos de carbono unidos a otros grupos funcionales químicos. Este nombre proviene de la nomenclatura química del siglo XIX, ya que las primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n (donde "n" es un entero=1,2,3... según el número de átomos). De aquí el término "carbono-hidratado" se haya mantenido, si bien posteriormente se vio que otras moléculas con las mismas características químicas no se corresponden con esta fórmula.
Sinónimos
Carbohidrato: aunque ha habido intentos para sustituir el término de hidratos de carbono, -debido a que se descubrió que realmente también están compuestos de oxígeno, aparte de carbono e hidrógeno- desde 1996 el Comité Conjunto de la Unión Internacional de Química Pura y Aplicada (International Union of Pure and Applied Chemistry [1]) y de la Unión Internacional de Bioquímica y Biología Molecular (International Union of Biochemistry and Molecular Biology) recomienda el término carbohidrato y desaconseja el de hidratos de carbono.
Glúcido: este nombre proviene de que pueden considerarse derivados de la glucosa por polimerización y pérdida de agua. El vocablo procede del griego "glycýs", que significa dulce.
Azúcares: este término sólo puede usarse para los monosacáridos (aldosas y cetosas) y los oligosacáridos inferiores (disacáridos). En singular (azúcar) se utiliza para referirse a la sacarosa o azúcar de mesa.
Estructura química
Los glúcidos son compuestos formados en su mayor parte por átomos de carbono, hidrógeno y oxígeno, su función es producir energía.
En la naturaleza se encuentran en los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como las proteínas y los lípidos.
Tipos de Carbohidratos
Monosacáridos. son los que están formados por una molécula de azúcar
Disacáridos. Al hidrolizarse producen dos monosacáridos.(2 moléculas de azúcar)
Oligosacáridos. Al hidrolizarse se producen de tres a veinte moléculas de monosacáridos.
Polisacáridos. Al hidrolizarse producen más de veinte moléculas de monosacáridos.(miles de moléculas de azúcar)
Monosacáridos
Como ya señalamos, en una primera aproximación, son polihidroxialdehídos o polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Una hexosa es por tanto, un monosacárido de seis átomos de carbono. Si el carbonilo se presenta como aldehído será una aldohexosa y si se presenta de forma similar a una cetona, diremos es una cetohexosa.
La mayoría de los monosacáridos naturales son pentosas o hexosas.
Pentosa Hexosa Hexosa
Aldopentosa Aldohexosa Cetohexosa
Para representar estructuras de carbohidratos, se utiliza una representación abreviada, las fórmulas de proyección de Fischer. Las fórmulas de proyección de Fischer, resultan cómodas para representar estructuras y por tanto, se continúan utilizando, igual que el convenio de clasificar los carbohidratos como pertenecientes a las familias D o L, en lugar de utilizar el convenio mucho más actual de clasificar R o S (Cahn-Igold-Prelog). Digamos D(+) gliceraldehido, D porque el –OH está a la derecha y el signo (+) se refiere solo a la rotación de luz polarizada, es una molécula dextrógira. Así un carbohidrato que presenta el –OH del estereocentro más alejado del carbonilo a la derecha, se clasifica como D. si estuviera a la izquierda, se clasifica como perteneciente a la familia L o serie L.
Algunas aldopentosas naturales:
D-Ribosa 2- Dexoxi- D-Xilosa D-Arabinosa
D-ribosa
La ribosa y la dexoxiribosa forman parte de los ácidos nucleicos. La ribosa también se aisla de la hidrólisis de la riboflavina (vitamina B2). El prefijo "dexoxi" se refiere a que este monosacárido contiene menos átomos de oxígeno que lo común, incumple con la fórmula Cn(H20)n.
La xilosa y la arabinosa, pueden aislarse de los productos de hidrólisis de las resinas vegetales, recibiendo la xilosa también la denominación de "azúcar de madera". La D(-) Arabinosa se encuentra también en bacterias y esponjas. Las hexosas naturales más comunes son:
D(+)- Glucosa D(+)-Manosa D(+)-Galactosa L(+)- Ramnosa D(-)- Fructosa
La glucosa también recibe el nombre de dextrosa por ser dextrorrotatoria (D(+)-Glucosa), también azúcar de sangre, pues está presente en la sangre humana en concentración de 65-110 mg/100 ml. Es posiblemente el producto natural más abundante pues se encuentra como polisacárido en el almidón, la celulosa y el glucógeno. También aparece combinada como disacárido en el azúcar común, la sacarosa (fructosa y glucosa) y en la leche de todos los mamíferos, lactosa, azúcar de leche (galactosa y glucosa).
La glucosa, galactosa y ramnosa forman con frecuencia parte de glicósidos naturales. Los glicósodos son compuestos con una estrucura formada por uno o más carbohidratos que se enlazan a una molécula que no es un carbohidrato. El conjunto se llama glicósido y la porción que no es un carbohidrato se denomina aglicón.
La fructosa es un ejemplo de cetohexosa, es entre los azúcares el compuesto más dulce, tiene bastante más poder edulcorante que la sacarosa, donde se encuentra enlazada con la glucosa. Esta cetohexosa se encuentra libre en la miel y en muchas frutas.
La D(+)-Manosa, se encuentra formando muchos polisacáridos naturales.
3.1 Ciclación de los monosacáridos
Analicemos lo dicho anteriormente respecto a que los carbohidratos, en forma de polihidroxialdehídos o polihidroxicetonas, en solución acuosa, permanecen en pequeñas proporciones con sus formas cíclicas, que son las más abundantes.
Por ataque nucleofílica de los electrones del oxígeno hidroxílico, sobre el carbono carbonílico, las aldosas o cetosas, de cuatro, cinco y seis átomos de carbono formas estrucrtura cíclicas hemiacetálicas.
Aldotetrosa forma hemiacetálica
Forma aldehídica
de cadena abierta
La estructura cíclica posee un carbono hemiacetálico, a él están unidos, un hidrógeno, un hidroxilo, un grupo R-O- y un grupo R.
Debemos decir que en solución acuosa el equilibrio es muy favorable a la forma cíclica.
Las aldopentosas se convierten en formas hemiacetálicas cíclicas, por reacción entre su grupo carbonilo y los hidroxilos situados en los C4 y en C5. De esto resultan anillos de 5 y seis miembros. Lo mismo ocurre con las aldohexosas, aunque estas forman peferentemente ciclos o anilos de seis miembros.
Muy importante es tener en cuenta que el grupo carbonilo es plano, puede recibir el ataque nucleofílico del hidroxilo por cualquiera de sus dos caras, el carbono carbonílico se convirtió en un estereocentro tetraédrico, la ciclación ha generado dos nuevos diasteroisómeros que se denominan anómeros, son los anómeros α y β y el nuevo estereocentro se llama el carbono anomιrico.
En solución acuosa, la forma abierta de la D-ribosa, permanece en equilibrio con cuatro formas cíclicas:
Reacción del –OH del C4 con el C=O Dos anillos de cinco miembros.
Reacción del –OH del C5 con el C=O Dos anillos de seis miembros.
Un monosacárido formando anillos de cinco miembros, se dice que es una furanosa, si es de seis miembros se dice que es una piranosa. Las denominaciones provienen de los heterociclos furano y pirano.
Glucosa - forma dextrógira
Fructosa - forma dextrógira
Ribosa - forma furanosa
Los hidratos de carbono son una clase básica de compuestos químicos en bioquímica. Son la forma biológica primaria de almacenamiento o consumo de energía; otras formas son las grasas y las proteínas.
El término hidrato de carbono es poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino de átomos de carbono unidos a otros grupos funcionales químicos. Este nombre proviene de la nomenclatura química del siglo XIX, ya que las primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n (donde "n" es un entero=1,2,3... según el número de átomos). De aquí el término "carbono-hidratado" se haya mantenido, si bien posteriormente se vio que otras moléculas con las mismas características químicas no se corresponden con esta fórmula.
Sinónimos
Carbohidrato: aunque ha habido intentos para sustituir el término de hidratos de carbono, -debido a que se descubrió que realmente también están compuestos de oxígeno, aparte de carbono e hidrógeno- desde 1996 el Comité Conjunto de la Unión Internacional de Química Pura y Aplicada (International Union of Pure and Applied Chemistry [1]) y de la Unión Internacional de Bioquímica y Biología Molecular (International Union of Biochemistry and Molecular Biology) recomienda el término carbohidrato y desaconseja el de hidratos de carbono.
Glúcido: este nombre proviene de que pueden considerarse derivados de la glucosa por polimerización y pérdida de agua. El vocablo procede del griego "glycýs", que significa dulce.
Azúcares: este término sólo puede usarse para los monosacáridos (aldosas y cetosas) y los oligosacáridos inferiores (disacáridos). En singular (azúcar) se utiliza para referirse a la sacarosa o azúcar de mesa.
Estructura química
Los glúcidos son compuestos formados en su mayor parte por átomos de carbono, hidrógeno y oxígeno, su función es producir energía.
En la naturaleza se encuentran en los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como las proteínas y los lípidos.
Tipos de Carbohidratos
Monosacáridos. son los que están formados por una molécula de azúcar
Disacáridos. Al hidrolizarse producen dos monosacáridos.(2 moléculas de azúcar)
Oligosacáridos. Al hidrolizarse se producen de tres a veinte moléculas de monosacáridos.
Polisacáridos. Al hidrolizarse producen más de veinte moléculas de monosacáridos.(miles de moléculas de azúcar)
Monosacáridos
Como ya señalamos, en una primera aproximación, son polihidroxialdehídos o polihidroxicetonas. La estructura contiene pues, varios grupos hidroxilos y un grupo carbonilo. El sufijo que se utiliza al referirnos a ellos es "osa". Una hexosa es por tanto, un monosacárido de seis átomos de carbono. Si el carbonilo se presenta como aldehído será una aldohexosa y si se presenta de forma similar a una cetona, diremos es una cetohexosa.
La mayoría de los monosacáridos naturales son pentosas o hexosas.
Pentosa Hexosa Hexosa
Aldopentosa Aldohexosa Cetohexosa
Para representar estructuras de carbohidratos, se utiliza una representación abreviada, las fórmulas de proyección de Fischer. Las fórmulas de proyección de Fischer, resultan cómodas para representar estructuras y por tanto, se continúan utilizando, igual que el convenio de clasificar los carbohidratos como pertenecientes a las familias D o L, en lugar de utilizar el convenio mucho más actual de clasificar R o S (Cahn-Igold-Prelog). Digamos D(+) gliceraldehido, D porque el –OH está a la derecha y el signo (+) se refiere solo a la rotación de luz polarizada, es una molécula dextrógira. Así un carbohidrato que presenta el –OH del estereocentro más alejado del carbonilo a la derecha, se clasifica como D. si estuviera a la izquierda, se clasifica como perteneciente a la familia L o serie L.
Algunas aldopentosas naturales:
D-Ribosa 2- Dexoxi- D-Xilosa D-Arabinosa
D-ribosa
La ribosa y la dexoxiribosa forman parte de los ácidos nucleicos. La ribosa también se aisla de la hidrólisis de la riboflavina (vitamina B2). El prefijo "dexoxi" se refiere a que este monosacárido contiene menos átomos de oxígeno que lo común, incumple con la fórmula Cn(H20)n.
La xilosa y la arabinosa, pueden aislarse de los productos de hidrólisis de las resinas vegetales, recibiendo la xilosa también la denominación de "azúcar de madera". La D(-) Arabinosa se encuentra también en bacterias y esponjas. Las hexosas naturales más comunes son:
D(+)- Glucosa D(+)-Manosa D(+)-Galactosa L(+)- Ramnosa D(-)- Fructosa
La glucosa también recibe el nombre de dextrosa por ser dextrorrotatoria (D(+)-Glucosa), también azúcar de sangre, pues está presente en la sangre humana en concentración de 65-110 mg/100 ml. Es posiblemente el producto natural más abundante pues se encuentra como polisacárido en el almidón, la celulosa y el glucógeno. También aparece combinada como disacárido en el azúcar común, la sacarosa (fructosa y glucosa) y en la leche de todos los mamíferos, lactosa, azúcar de leche (galactosa y glucosa).
La glucosa, galactosa y ramnosa forman con frecuencia parte de glicósidos naturales. Los glicósodos son compuestos con una estrucura formada por uno o más carbohidratos que se enlazan a una molécula que no es un carbohidrato. El conjunto se llama glicósido y la porción que no es un carbohidrato se denomina aglicón.
La fructosa es un ejemplo de cetohexosa, es entre los azúcares el compuesto más dulce, tiene bastante más poder edulcorante que la sacarosa, donde se encuentra enlazada con la glucosa. Esta cetohexosa se encuentra libre en la miel y en muchas frutas.
La D(+)-Manosa, se encuentra formando muchos polisacáridos naturales.
3.1 Ciclación de los monosacáridos
Analicemos lo dicho anteriormente respecto a que los carbohidratos, en forma de polihidroxialdehídos o polihidroxicetonas, en solución acuosa, permanecen en pequeñas proporciones con sus formas cíclicas, que son las más abundantes.
Por ataque nucleofílica de los electrones del oxígeno hidroxílico, sobre el carbono carbonílico, las aldosas o cetosas, de cuatro, cinco y seis átomos de carbono formas estrucrtura cíclicas hemiacetálicas.
Aldotetrosa forma hemiacetálica
Forma aldehídica
de cadena abierta
La estructura cíclica posee un carbono hemiacetálico, a él están unidos, un hidrógeno, un hidroxilo, un grupo R-O- y un grupo R.
Debemos decir que en solución acuosa el equilibrio es muy favorable a la forma cíclica.
Las aldopentosas se convierten en formas hemiacetálicas cíclicas, por reacción entre su grupo carbonilo y los hidroxilos situados en los C4 y en C5. De esto resultan anillos de 5 y seis miembros. Lo mismo ocurre con las aldohexosas, aunque estas forman peferentemente ciclos o anilos de seis miembros.
Muy importante es tener en cuenta que el grupo carbonilo es plano, puede recibir el ataque nucleofílico del hidroxilo por cualquiera de sus dos caras, el carbono carbonílico se convirtió en un estereocentro tetraédrico, la ciclación ha generado dos nuevos diasteroisómeros que se denominan anómeros, son los anómeros α y β y el nuevo estereocentro se llama el carbono anomιrico.
En solución acuosa, la forma abierta de la D-ribosa, permanece en equilibrio con cuatro formas cíclicas:
Reacción del –OH del C4 con el C=O Dos anillos de cinco miembros.
Reacción del –OH del C5 con el C=O Dos anillos de seis miembros.
Un monosacárido formando anillos de cinco miembros, se dice que es una furanosa, si es de seis miembros se dice que es una piranosa. Las denominaciones provienen de los heterociclos furano y pirano.
Ecuación de Henderson-Hasselbalch
La ecuación de Henderson-Hasselbalch (frecuentemente mal escrito como Henderson-Hasselbach) se utiliza para calcular el pH de una solución buffer o tampón, a partir del pKa (la constante de disociación del ácido) y de las concentraciones de equilibrio del ácido o base, del acido o la base conjugada.
Observaciones
La ecuación implica muchos samueles, el uso de las concentraciones de equilibrio del ácido y su base conjugada. Para el cálculo del pH en soluciones buffer, generalmente se hace una simplificación y se utilizan las concentraciones iniciales del ácido y la sal, por lo tanto se debe tener en cuenta que el valor obtenido es una aproximación y que el error sera mayor cuanto mayor sea la diferencia de las concentraciones de equilibrio con las de partida (constante de equilibrio alta). En la misma aproximación, tampoco se considera el aporte del agua, lo cual no es válido para soluciones muy diluidas.
Derivación
Supongamos un ácido AH con disociación parcial. El equilibrio es:
y la constante de disociación asociada sera:
Despejando [H3O + ] de la constante de disociación:
Tomando logaritmos a ambos lados y aplicando la propiedad de los logaritmos para un producto se llega a:
E invirtiendo el cociente:
ph=pka+log[A]
[HA]
Observaciones
La ecuación implica muchos samueles, el uso de las concentraciones de equilibrio del ácido y su base conjugada. Para el cálculo del pH en soluciones buffer, generalmente se hace una simplificación y se utilizan las concentraciones iniciales del ácido y la sal, por lo tanto se debe tener en cuenta que el valor obtenido es una aproximación y que el error sera mayor cuanto mayor sea la diferencia de las concentraciones de equilibrio con las de partida (constante de equilibrio alta). En la misma aproximación, tampoco se considera el aporte del agua, lo cual no es válido para soluciones muy diluidas.
Derivación
Supongamos un ácido AH con disociación parcial. El equilibrio es:
y la constante de disociación asociada sera:
Despejando [H3O + ] de la constante de disociación:
Tomando logaritmos a ambos lados y aplicando la propiedad de los logaritmos para un producto se llega a:
E invirtiendo el cociente:
ph=pka+log[A]
[HA]
acidos y bases
Ácidos & Bases
Desde hace miles de años se sabe que el vinagre, el jugo de limón y muchos otros alimentos tienen un sabor ácido. Sin embargo, no fue hasta hace unos cuantos cientos de años que se descubrió por qué estas cosas tenían un sabor ácido. El término ácido, en realidad, proviene del término Latino acere, que quiere decir ácido. Anque hay muchas diferentes definiciones de los ácidos y las bases, en esta lección introduciremmos los fundamentos de la química de los ácidos y las bases.
En el siglo XVII, el escritor irlandés y químico amateur Robert Boyle primero denominó las substancias como ácidos o bases (llamó a las bases alcalis) de acuerdo a las siguientes características:
Los Ácidos tienen un sabor ácido,corroen el metal, cambian el litmus tornasol (una tinta extraída de los líquenes) a rojo, y se vuelven menos ácidos cuando se mezclan con las bases.
Las Bases son resbaladizas, cambian el litmus a azul, y se vuelven menos básicas cuando se mezclan con ácidos.
Aunque Boyle y otros trataron de explicar por qué los ácidos y las bases se comportan de tal manera, la primera definición razonable de los ácidos y las bases no sería propuesta hasta 200 años después.
Afinales de 1800, el científico sueco Svante Arrhenius propuso que el agua puede disolver muchos compuestos separándolos en sus iones individuales. Arrhenius sugirió que los ácidos son compuestos que contienen hidrógeno y pueden disolverse en el agua para soltar iones de hidrógeno a la solución. Por ejemplo, el ácido clorídrico (HCl) se disuelve en el agua de la siguiente manera:
HCl
H2O
H+(aq)
+
Cl-(aq)
Arrhenius definió las bases como substancias que se disuelven en el agua para soltar iones de hidróxido (OH-) a la solución. Por ejemplo, una base típica de acuerdo a la definición de Arrhenius es el hidróxido de sodio (NaOH):
NaOH
H2O
Na+(aq)
+
OH-(aq)
La definición de los ácidos y las bases de Arrhenius explica un sinnúmero de cosas. La teoría de Arrhenius explica el por qué todos los ácidos tienen propiedades similares (y de la misma manera por qué todas las bases son similares). Por que todos los ácidos sueltan H+ ia la solución (y todas las bases sueltan OH-). La definición de Arrhenius también explica la observación de Boyle que los ácidos y las bases se neutralizan entre ellos. Esta idea, que una base puede debilitar un ácido, y vice versa, es llamada neutralización.
La Neutralización: Tal como puede ver arriba, los ácidos sueltan H+ en la solución y las bases sueltan OH-. Si fuésemos a mezclar un ácido y una base, el ión H+ se combinaría con el ión OH- ion para crear la molécula H2O, o simplemente agua:
H+(aq)
+
OH-(aq)
H2O
La reacción neutralizante de un ácido con una base siempre producirá agua y sal, tal como se muestra abajo:
Ácido
Base
Agua
Sal
HCl
+
NaOH
H2O
+
NaCl
HBr
+
KOH
H2O
+
KBr
Aunque Arrhenius ayudó a explicar los fundamentos de la química sobre ácidos y bases, lastimosamente sus teorías tenían límites. Por ejemplo, la definición de Arrhenius no explica por qué algunas substancias como la levadura común (NaHCO3) puede actuar como una base, a pesar de que no contenga iones de hidrógeno.
En 1923, el científico danés Johannes Brønsted y el inglés Thomas Lowry publicaron diferentes aunque similares trabajos que redefinieron la teoría de Arrhenius. En las palabras de Brønsted's words, "... los ácidos y las bases son substancias que tiene la capacidad de dividirse o tomar iones de hidrógeno respectivamente." La definición de Brønsted-Lowry ampliar el concepto de Arrhenius sobre los ácidos y las bases. La definición de Brønsted-Lowry sobre los ácidos es muy similar a la de Arrhenius, cualquier substancia que pueda donar un ión de hidrógeno, es un ácido (en la definición de Brønsted, los ácidos son comúnmente referidos como donantes de protones porque un ión- hidrógeno H+ menos su electrón - es simplemente un protón).
Sin embargo, la definición de Brønsted de las bases es bastante diferente de la definición de Arrhenius. La base de Brønsted es definida como cualquier substancia que puede aceptar un ión de hidrógeno. Esencialmente, la base es el opuesto de un ácido. El NaOH y el KOH, tal como vimos arriba, segruirían siendo consideradas bases porque pueden aceptar un H+ de un ácido para formar agua. Sin embargo, la definición de Brønsted-Lowry también explica por que las substancias que no contienen OH- pueden actuar como bases. La levadura (NaHCO3), por ejemplo, actua como una base al aceptar un ión de hidrógeno de un ácido tal como se ilustra siguientemente:
Acid
Base
Salt
HCl
+
NaHCO3
H2CO3
+
NaCl
pHEn la definición de Brønsted-Lowry, ambos los ácidos y las bases están relacionados con la concentración del ión de hidrógeno presente. Los ácidos aumentan la concentración de iones de hidrógeno, mientras que las bases disminuyen en la concentración de iones de hidrógeno (al aceptarlos). Por consiguiente, la acidez o la alcalinidad de algo puede ser medida por su concentración de iones de hidrógeno.
En 1909, el bioquímico danés Sören Sörensen inventó la escala pH para medir la acidez. La escala pH está descrita en la fórmula:
pH = -log [H+]
Nota: la concentración es comúmente abreviada usando logaritmo, por consiguiente H+] = concentración de ión de hidrógeno. Cuando se mide el pH, [H+] es una unidad de moles H+ por litro de solución
Por ejemplo, una solución con [H+] = 1 x 10-7 moles/litro tiene un pH = 7 (una manera más simple de pensar en el pH es que es igual al exponente del H+ de la concentración, ignorando el signo de menos). La escala pH va de 0 a 14. Las substancias con un pH entre S 0 o menos de 7 son ácidos (pH y [H+] están inversamente relacionados, menor pH significa mayor [H+]). Las substancias con un pH mayor a 7 y hasta 14 son bases (mayor pH significa menor [H+]). Exactamente en el medio, en pH = 7, están las substancias neutra s, por ejemplo, el agua pura. La relación entre [H+] y pH está mostrada en la tabla de abajo, junto algunos comunes ejemplos de ácidos y base de la vida cotidiana.
[H+]
pH
Ejemplo
Ácidos
1 X 1-0
HCl
1 x 10-1
Äcido estomacal
1 x 10-2
Jugo de limón
1 x 10-3
Vinagre
1 x 10-4
Soda
1 x 10-5
Agua de lluvia
1 x 10-6
Leche
Neutral
1 x 10-7
Agua pura
Bases
1 x 10-8
Claras de huevo
1 x 10-9
Levadura
1 x 10-10
Tums®antiácidos
1 x 10-11
Amoníaco
1 x 10-12
Caliza Mineral - Ca(OH)2
1 x 10-13
Drano®
1 x 10-14
NaOH
CONCENTRACION DE SOLUCIONES
SOLUCIONES
INTRODUCCIÓN
Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. en cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
La concentración de una solución expresa la relación de la cantidad de soluto a la cantidad de solvente.
Las soluciones poseen una serie de propiedades que las caracterizan :
1.
Su composición química es variable.
2.
Las propiedades químicas de los componentes de una solución no se alteran.
3.
Las propiedades físicas de la solución son diferentes a las del solvente puro : la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
· PRINCIPALES CLASES DE SOLUCIONES
SOLUCIÓN
DISOLVENTE
SOLUTO
EJEMPLOS
Gaseosa
Gas
Gas
Aire
Liquida
Liquido
Liquido
Alcohol en agua
Liquida
Liquido
Gas
O2 en H2O
Liquida
Liquido
Sólido
NaCl en H2O
· SOLUBILIDAD
La solubilidad es la cantidad máxima de un soluto que puede disolverse en una cantidad dada de solvente a una determinada temperatura.
Factores que afectan la solubilidad:
Los factores que afectan la solubilidad son:
a) Superficie de contacto: La interacción soluto-solvente aumenta cuando hay mayor superficie de contacto y el cuerpo se disuelve con más rapidez ( pulverizando el soluto).
b) Agitación: Al agitar la solución se van separando las capas de disolución que se forman del soluto y nuevas moléculas del solvente continúan la disolución
c) Temperatura: Al aument6ar la temperatura se favorece el movimiento de las moléculas y hace que la energía de las partículas del sólido sea alta y puedan abandonar su superficie disolviéndose.
d) Presión: Esta influye en la solubilidad de gases y es directamente proporcional
· MODO DE EXPRESAR LAS CONCENTRACIONES
La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. Los términos diluida o concentrada expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.
b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
d) Fracción molar (Xi): se define como la relación entre las moles de un componente y las moles totales presentes en la solución.
Xsto + Xste = 1
e) Molaridad ( M ): Es el número de moles de soluto contenido en un litro de solución. Una solución 3 molar ( 3 M ) es aquella que contiene tres moles de soluto por litro de solución.
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1M?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 ml. H20
Usando la definición de molalidad , se tiene que en una solución 1M hay 1 mol de AgNO3 por cada Litro (1000 ml ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
Se necesitan 17 g de AgNO3 para preparar una solución 1 M
f) Molalidad (m): Es el número de moles de soluto contenidos en un kilogramo de solvente. Una solución formada por 36.5 g de ácido clorhídrico, HCl , y 1000 g de agua es una solución 1 molal (1 m)
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1m?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 gr. H20
Usando la definición de molalidad , se tiene que en una solución 1m hay 1 mol de AgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
Se necesitan 17 g de AgNO3 para preparar una solución 1 m, observe que debido a que la densidad del agua es 1.0 g/ml la molaridad y la molalidad del AgNO3 es la misma
g) Normalidad (N): Es el número de equivalentes gramo de soluto contenidos en un litro de solución.
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1N?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 gr. H20
Usando la definición de molalidad , se tiene que en una solución 1N hay 1 mol de AgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
El peso equivalente de un compuesto se calcula dividiendo el peso molecular del compuesto por su carga total positiva o negativa.
h) Formalidad (F): Es el cociente entre el número de pesos fórmula gramo (pfg) de soluto que hay por cada litro de solución. Peso fórmula gramo es sinónimo de peso molecular. La molaridad (M) y la formalidad (F) de una solución son numéricamente iguales, pero la unidad formalidad suele preferirse cuando el soluto no tiene un peso molecular definido, ejemplo: en los sólidos iónicos.
· SOLUCIONES DE ELECTROLITOS
Electrolitos:
Son sustancias que confieren a una solución la capacidad de conducir la corriente eléctrica. Las sustancias buenas conductoras de la electricidad se llaman electrolitos fuertes y las que conducen la electricidad en mínima cantidad son electrolitos débiles.
Electrolisis:
Son las transformaciones químicas que producen la corriente eléctrica a su paso por las soluciones de electrolitos.
Al pasar la corriente eléctrica, las sales, los ácidos y las bases se ionizan.
EJEMPLOS:
NaCl
→
Na+
+
Cl-
CaSO4
→
Ca+2
+
SO4-2
HCl
→
H+
+
Cl-
AgNO3
→
Ag+
+
NO3-
NaOH
→
Na+
+
OH-
Los iones positivos van al polo negativo o cátodo y los negativos al polo positivo o ánodo.
· PRODUCTO IÓNICO DEL H2O
El H2O es un electrolito débil. Se disocia así:
H2O
H +
+
OH-
La constante de equilibrio para la disociación del H2O es :
El símbolo [ ] indica la concentración molar
Keq [H2O]
=
[H + ]
+
[OH-].
La concentración del agua sin disociar es elevada y se puede considerar constante.
· Valor del producto iónico del H2O( 10-14 moles/litro).
En el agua pura el número de iones H+ y OH- es igual. Experimentalmente se ha demostrado que un litro de agua contiene una diez millonésima del numero H+ e igual de OH-; esto se expresa como 10-7 por tanto, la concentración molar de H+ se expresa asi
[H + ]= 10-7 moles/litro y [OH-] = 10-7; entonces; [H2O] = 10-7 moles / litro [H2O] = 10-14 moles/litro.
Si se conoce la concentración de uno de los iones del H2O se puede calcular la del otro.
EJEMPLO:
· Si se agrega un ácido al agua hasta que la concentración del H+ sea de 1 x 104 moles / litro, podemos determinar la concentración de los iones OH-; la presencia del ácido no modifica el producto iónico de H2O:
[H2O]
=
[H + ]
[OH-] =
10-14 de donde
Si se añade una base (NaOH) al H2O hasta que la concentración de iones OH- sea 0.00001 moles/ litro ( 1 X 10-5); se puede calcular la concentración de iones H+.
[H2O]
=
[H + ]
[OH-] =
10-14 de donde;
[H + ]10-5
=
10-14; entonces;
· POTENCIAL DE HIDROGENACIÓN O pH
El pH de una solución acuosa es igual al logaritmo negativo de la concentración de iones H+ expresado en moles por litro
Escala de pH;
El pOH es igual al logaritmo negativo de la concentración molar de iones OH. Calcular el pH del agua pura
Log 1.0 x 107
Log 1.0
+
log 107
=
0 + 7 = 7
el pH del agua es 7
EJEMPLO:
· Cuál es el pH de una solución de 0.0020 M de HCl?
Log 5 + log 102 = 0.7 + 2 = 2.7
Respuesta: el pH de la solución es de 2.7
· INDICADORES
Son sustancias que pueden utilizarse en formas de solución o impregnadas en papeles especiales y que cambian de color según el grado del pH
INDICADOR
MEDIO ÁCIDO
MEDIO BÁSICO
Fenoftaleina
incoloro
rojo
Tornasol
rojo
azul
Rojo congo
azul
rojo
Alizarina
amarillo
rojo naranja
COLOIDES
los coloides son mezclas intermedias entre las soluciones y las mezclas propiamente dichas; sus partículas son de tamaño mayor que el de las soluciones ( 10 a 10.000 Aº se llaman micelas).
Los componentes de un coloide se denominan fase dispersa y medio dispersante. Según la afinidad de los coloides por la fase dispersante se clasifican en liófilos si tienen afinidad y liófobos si no hay afinidad entre la sustancia y el medio.
Clase de coloides según el estado físico
NOMBRE
EJEMPLOS
FASE DISPERSA
MEDIO DISPERSANTE
Aerosol sólido
Polvo en el aire
Sólido
Gas
Geles
Gelatinas, tinta, clara de huevo
Sólido
Liquido
Aerosol liquido
Niebla
Liquido
Gas
Emulsión
leche, mayonesa
Liquido
Liquido
Emulsión sólida
Pinturas, queso
Liquido
Sólido
Espuma
Nubes, esquemas
Gas
Liquido
Espuma sólida
Piedra pómez
Gas
Sólido
· PROPIEDADES DE LOS COLOIDES
Las propiedades de los coloides son :
· Movimiento browniano: Se observa en un coloide al ultramicroscopio, y se caracteriza por un movimiento de partículas rápido, caótico y continuo; esto se debe al choque de las partículas dispersas con las del medio.
· Efecto de Tyndall Es una propiedad óptica de los coloides y consiste en la difracción de los rayos de luz que pasan a través de un coloide. Esto no ocurre en otras sustancias.
· Adsorción : Los coloides son excelentes adsorbentes debido al tamaño pequeño de las partículas y a la superficie grande. EJEMPLO: el carbón activado tiene gran adsorción, por tanto, se usa en los extractores de olores; esta propiedad se usa también en cromatografía.
· Carga eléctrica : Las partículas presentan cargas eléctricas positivas o negativas. Si se trasladan al mismo tiempo hacia el polo positivo se denomina anaforesis; si ocurre el movimiento hacia el polo negativo, cataforesis.
INTRODUCCIÓN
Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. en cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
La concentración de una solución expresa la relación de la cantidad de soluto a la cantidad de solvente.
Las soluciones poseen una serie de propiedades que las caracterizan :
1.
Su composición química es variable.
2.
Las propiedades químicas de los componentes de una solución no se alteran.
3.
Las propiedades físicas de la solución son diferentes a las del solvente puro : la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste.
· PRINCIPALES CLASES DE SOLUCIONES
SOLUCIÓN
DISOLVENTE
SOLUTO
EJEMPLOS
Gaseosa
Gas
Gas
Aire
Liquida
Liquido
Liquido
Alcohol en agua
Liquida
Liquido
Gas
O2 en H2O
Liquida
Liquido
Sólido
NaCl en H2O
· SOLUBILIDAD
La solubilidad es la cantidad máxima de un soluto que puede disolverse en una cantidad dada de solvente a una determinada temperatura.
Factores que afectan la solubilidad:
Los factores que afectan la solubilidad son:
a) Superficie de contacto: La interacción soluto-solvente aumenta cuando hay mayor superficie de contacto y el cuerpo se disuelve con más rapidez ( pulverizando el soluto).
b) Agitación: Al agitar la solución se van separando las capas de disolución que se forman del soluto y nuevas moléculas del solvente continúan la disolución
c) Temperatura: Al aument6ar la temperatura se favorece el movimiento de las moléculas y hace que la energía de las partículas del sólido sea alta y puedan abandonar su superficie disolviéndose.
d) Presión: Esta influye en la solubilidad de gases y es directamente proporcional
· MODO DE EXPRESAR LAS CONCENTRACIONES
La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. Los términos diluida o concentrada expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.
b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
d) Fracción molar (Xi): se define como la relación entre las moles de un componente y las moles totales presentes en la solución.
Xsto + Xste = 1
e) Molaridad ( M ): Es el número de moles de soluto contenido en un litro de solución. Una solución 3 molar ( 3 M ) es aquella que contiene tres moles de soluto por litro de solución.
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1M?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 ml. H20
Usando la definición de molalidad , se tiene que en una solución 1M hay 1 mol de AgNO3 por cada Litro (1000 ml ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
Se necesitan 17 g de AgNO3 para preparar una solución 1 M
f) Molalidad (m): Es el número de moles de soluto contenidos en un kilogramo de solvente. Una solución formada por 36.5 g de ácido clorhídrico, HCl , y 1000 g de agua es una solución 1 molal (1 m)
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1m?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 gr. H20
Usando la definición de molalidad , se tiene que en una solución 1m hay 1 mol de AgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
Se necesitan 17 g de AgNO3 para preparar una solución 1 m, observe que debido a que la densidad del agua es 1.0 g/ml la molaridad y la molalidad del AgNO3 es la misma
g) Normalidad (N): Es el número de equivalentes gramo de soluto contenidos en un litro de solución.
EJEMPLO:* Cuántos gramos de AgNO3 , se necesitan para preparar 100 cm3 de solución 1N?
Previamente sabemos que:
El peso molecular de AgNO3 es:
170 g
=
masa de 1 mol AgNO3
y que
100 de H20 cm3
equivalen
a
100 gr. H20
Usando la definición de molalidad , se tiene que en una solución 1N hay 1 mol de AgNO3 por cada kg (1000 g ) de H2O (solvente) es decir:
Utilizando este factor de conversión y los datos anteriores tenemos que:
El peso equivalente de un compuesto se calcula dividiendo el peso molecular del compuesto por su carga total positiva o negativa.
h) Formalidad (F): Es el cociente entre el número de pesos fórmula gramo (pfg) de soluto que hay por cada litro de solución. Peso fórmula gramo es sinónimo de peso molecular. La molaridad (M) y la formalidad (F) de una solución son numéricamente iguales, pero la unidad formalidad suele preferirse cuando el soluto no tiene un peso molecular definido, ejemplo: en los sólidos iónicos.
· SOLUCIONES DE ELECTROLITOS
Electrolitos:
Son sustancias que confieren a una solución la capacidad de conducir la corriente eléctrica. Las sustancias buenas conductoras de la electricidad se llaman electrolitos fuertes y las que conducen la electricidad en mínima cantidad son electrolitos débiles.
Electrolisis:
Son las transformaciones químicas que producen la corriente eléctrica a su paso por las soluciones de electrolitos.
Al pasar la corriente eléctrica, las sales, los ácidos y las bases se ionizan.
EJEMPLOS:
NaCl
→
Na+
+
Cl-
CaSO4
→
Ca+2
+
SO4-2
HCl
→
H+
+
Cl-
AgNO3
→
Ag+
+
NO3-
NaOH
→
Na+
+
OH-
Los iones positivos van al polo negativo o cátodo y los negativos al polo positivo o ánodo.
· PRODUCTO IÓNICO DEL H2O
El H2O es un electrolito débil. Se disocia así:
H2O
H +
+
OH-
La constante de equilibrio para la disociación del H2O es :
El símbolo [ ] indica la concentración molar
Keq [H2O]
=
[H + ]
+
[OH-].
La concentración del agua sin disociar es elevada y se puede considerar constante.
· Valor del producto iónico del H2O( 10-14 moles/litro).
En el agua pura el número de iones H+ y OH- es igual. Experimentalmente se ha demostrado que un litro de agua contiene una diez millonésima del numero H+ e igual de OH-; esto se expresa como 10-7 por tanto, la concentración molar de H+ se expresa asi
[H + ]= 10-7 moles/litro y [OH-] = 10-7; entonces; [H2O] = 10-7 moles / litro [H2O] = 10-14 moles/litro.
Si se conoce la concentración de uno de los iones del H2O se puede calcular la del otro.
EJEMPLO:
· Si se agrega un ácido al agua hasta que la concentración del H+ sea de 1 x 104 moles / litro, podemos determinar la concentración de los iones OH-; la presencia del ácido no modifica el producto iónico de H2O:
[H2O]
=
[H + ]
[OH-] =
10-14 de donde
Si se añade una base (NaOH) al H2O hasta que la concentración de iones OH- sea 0.00001 moles/ litro ( 1 X 10-5); se puede calcular la concentración de iones H+.
[H2O]
=
[H + ]
[OH-] =
10-14 de donde;
[H + ]10-5
=
10-14; entonces;
· POTENCIAL DE HIDROGENACIÓN O pH
El pH de una solución acuosa es igual al logaritmo negativo de la concentración de iones H+ expresado en moles por litro
Escala de pH;
El pOH es igual al logaritmo negativo de la concentración molar de iones OH. Calcular el pH del agua pura
Log 1.0 x 107
Log 1.0
+
log 107
=
0 + 7 = 7
el pH del agua es 7
EJEMPLO:
· Cuál es el pH de una solución de 0.0020 M de HCl?
Log 5 + log 102 = 0.7 + 2 = 2.7
Respuesta: el pH de la solución es de 2.7
· INDICADORES
Son sustancias que pueden utilizarse en formas de solución o impregnadas en papeles especiales y que cambian de color según el grado del pH
INDICADOR
MEDIO ÁCIDO
MEDIO BÁSICO
Fenoftaleina
incoloro
rojo
Tornasol
rojo
azul
Rojo congo
azul
rojo
Alizarina
amarillo
rojo naranja
COLOIDES
los coloides son mezclas intermedias entre las soluciones y las mezclas propiamente dichas; sus partículas son de tamaño mayor que el de las soluciones ( 10 a 10.000 Aº se llaman micelas).
Los componentes de un coloide se denominan fase dispersa y medio dispersante. Según la afinidad de los coloides por la fase dispersante se clasifican en liófilos si tienen afinidad y liófobos si no hay afinidad entre la sustancia y el medio.
Clase de coloides según el estado físico
NOMBRE
EJEMPLOS
FASE DISPERSA
MEDIO DISPERSANTE
Aerosol sólido
Polvo en el aire
Sólido
Gas
Geles
Gelatinas, tinta, clara de huevo
Sólido
Liquido
Aerosol liquido
Niebla
Liquido
Gas
Emulsión
leche, mayonesa
Liquido
Liquido
Emulsión sólida
Pinturas, queso
Liquido
Sólido
Espuma
Nubes, esquemas
Gas
Liquido
Espuma sólida
Piedra pómez
Gas
Sólido
· PROPIEDADES DE LOS COLOIDES
Las propiedades de los coloides son :
· Movimiento browniano: Se observa en un coloide al ultramicroscopio, y se caracteriza por un movimiento de partículas rápido, caótico y continuo; esto se debe al choque de las partículas dispersas con las del medio.
· Efecto de Tyndall Es una propiedad óptica de los coloides y consiste en la difracción de los rayos de luz que pasan a través de un coloide. Esto no ocurre en otras sustancias.
· Adsorción : Los coloides son excelentes adsorbentes debido al tamaño pequeño de las partículas y a la superficie grande. EJEMPLO: el carbón activado tiene gran adsorción, por tanto, se usa en los extractores de olores; esta propiedad se usa también en cromatografía.
· Carga eléctrica : Las partículas presentan cargas eléctricas positivas o negativas. Si se trasladan al mismo tiempo hacia el polo positivo se denomina anaforesis; si ocurre el movimiento hacia el polo negativo, cataforesis.
el agua
el agua y puentes de hidrogeno
El puente de hidrógeno es un enlace que se establece entre moléculas capaces de generar cargas parciales. El agua, es la sustancia en donde los puentes de hidrógeno son más efectivos, en su molécula, los electrones que intervienen en sus enlaces, están más cerca del oxígeno que de los hidrógenos y por esto se generan dos cargas parciales negativas en el extremo donde está el oxígeno y dos cargas parciales positivas en el extremo donde se encuentran los hidrógenos. La presencia de cargas parciales positivas y negativas hace que las moléculas de agua se comporten como imanes en los que las partes con carga parcial positiva atraen a las partes con cargas parciales negativas. De tal suerte que una sola molécula de agua puede unirse a otras 4 moléculas de agua a través de 4 puentes de hidrógeno. Esta característica es la que hace al agua un líquido muy especial.
Los puentes de Hidrógeno, se forman por átomos de Hidrógeno localizados entre átomos electronegativos. Cuando un átomo de Hidrógeno está unido covalentemente, a una átomo electronegativo, ej. Oxígeno o Nitrógeno, asume una densidad (d) de carga positiva, debido a la elevada electronegatividad del átomo vecino. Esta deficiencia parcial en electrones, hace a los átomos de Hidrógeno susceptibles de atracción por los electrones no compartidos en los átomos de Oxígeno o Nitrógeno
Obsérvese la configuración electrónica del Oxígeno:
8O 1s2 2s2 2pxêé pyé pzé
de ahí que :
d+ d+
d-
d+ d+
d-
Figura: configuración electrónica del Oxígeno
el puente de Hidrógeno es relativamente débil entre -20 y -30 kJ mol-1, la fuerza de enlace aumenta al aumentar la electronegatividad y disminuye con el tamaño de los átomos participantes. Por tanto, el puente de Hidrógeno existe en numerosas moléculas no solo en el agua. Aquí solo se tratará lo referente al agua.
La estructura del agua favorece las interacciones para formar puentes de Hidrógeno, el arreglo siempre es perpendicular entre las moléculas participantes, además, es favorecido por que cada protón unido a un Oxígeno muy electronegativo encuentra un electrón no compartido con el que interactúa uno a uno. De lo anterior se concluye que cada átomo d Oxígeno en el agua interacciona con 4 protones, dos de ellos unidos covalentemente y dos a través de puentes de Hidrógeno.
colineales
Figura: Información sobre los puentes de Hidrógeno
Estudios de difracción de rayos X indican que la distancia entre los átomos de Oxígeno que intervienen en el puente de Hidrógeno, están separados por 0.28 nm lo que indica un arreglo tetraédrico de las moléculas de agua, además los puentes de Hidrógeno:
TETRAHEDRO
Figura: representación de una molécula tetraédrica del agua.
La colinealidad de los puentes es muy importante, un alejamiento de 10° ocasiona la que el puente se rompa.
Linnus Pauling postuló a partir de observaciones de las transiciones moleculares (i.e. el movimiento de los átomos con respecto a aquellos a los que están unidos) de los átomos participantes en la molécula D2O (el deuterio forma parte de la pléyade de Hidrógeno), que el puente de Hidrógeno es la interacción más importante que juega un papel crítico no solo en la estructura del agua sino en la estructura y función de las macromoléculas biológicas.
El puente de hidrógeno es un enlace que se establece entre moléculas capaces de generar cargas parciales. El agua, es la sustancia en donde los puentes de hidrógeno son más efectivos, en su molécula, los electrones que intervienen en sus enlaces, están más cerca del oxígeno que de los hidrógenos y por esto se generan dos cargas parciales negativas en el extremo donde está el oxígeno y dos cargas parciales positivas en el extremo donde se encuentran los hidrógenos. La presencia de cargas parciales positivas y negativas hace que las moléculas de agua se comporten como imanes en los que las partes con carga parcial positiva atraen a las partes con cargas parciales negativas. De tal suerte que una sola molécula de agua puede unirse a otras 4 moléculas de agua a través de 4 puentes de hidrógeno. Esta característica es la que hace al agua un líquido muy especial.
Los puentes de Hidrógeno, se forman por átomos de Hidrógeno localizados entre átomos electronegativos. Cuando un átomo de Hidrógeno está unido covalentemente, a una átomo electronegativo, ej. Oxígeno o Nitrógeno, asume una densidad (d) de carga positiva, debido a la elevada electronegatividad del átomo vecino. Esta deficiencia parcial en electrones, hace a los átomos de Hidrógeno susceptibles de atracción por los electrones no compartidos en los átomos de Oxígeno o Nitrógeno
Obsérvese la configuración electrónica del Oxígeno:
8O 1s2 2s2 2pxêé pyé pzé
de ahí que :
d+ d+
d-
d+ d+
d-
Figura: configuración electrónica del Oxígeno
el puente de Hidrógeno es relativamente débil entre -20 y -30 kJ mol-1, la fuerza de enlace aumenta al aumentar la electronegatividad y disminuye con el tamaño de los átomos participantes. Por tanto, el puente de Hidrógeno existe en numerosas moléculas no solo en el agua. Aquí solo se tratará lo referente al agua.
La estructura del agua favorece las interacciones para formar puentes de Hidrógeno, el arreglo siempre es perpendicular entre las moléculas participantes, además, es favorecido por que cada protón unido a un Oxígeno muy electronegativo encuentra un electrón no compartido con el que interactúa uno a uno. De lo anterior se concluye que cada átomo d Oxígeno en el agua interacciona con 4 protones, dos de ellos unidos covalentemente y dos a través de puentes de Hidrógeno.
colineales
Figura: Información sobre los puentes de Hidrógeno
Estudios de difracción de rayos X indican que la distancia entre los átomos de Oxígeno que intervienen en el puente de Hidrógeno, están separados por 0.28 nm lo que indica un arreglo tetraédrico de las moléculas de agua, además los puentes de Hidrógeno:
TETRAHEDRO
Figura: representación de una molécula tetraédrica del agua.
La colinealidad de los puentes es muy importante, un alejamiento de 10° ocasiona la que el puente se rompa.
Linnus Pauling postuló a partir de observaciones de las transiciones moleculares (i.e. el movimiento de los átomos con respecto a aquellos a los que están unidos) de los átomos participantes en la molécula D2O (el deuterio forma parte de la pléyade de Hidrógeno), que el puente de Hidrógeno es la interacción más importante que juega un papel crítico no solo en la estructura del agua sino en la estructura y función de las macromoléculas biológicas.
sábado, 25 de agosto de 2007
experimento 4
La coca-cola Light se quedo en la superficie del agua que estaba contenida en la cubeta, y esto se debe a la densidad al igual que a sus productos con que es elaborada.
Y por el contrario la coca-cola normal se hundió igual por sus contenidos.
Y por el contrario la coca-cola normal se hundió igual por sus contenidos.
experimento 3
La explicación a esto fue que ocurrió una plasmolisis es decir que la papa se que de sin agua (deshidratada) en las células de esta misma, y para esto se ayudo de agua, cloruro de sodio.
experimento 2
Se debe a la densidad del glicerol que es más grande que la del agua, por tal motivo queda abajo el agua y arriba el glicerol.
experimento 1
La explicación de este experimento es que como el agua tiene cargas eléctricas debido a los iones que tienen las sales del agua. Y eso hace
En este caso de que el agua sea pura quiere decir que no va a tener cargas eléctricas.
Este comportamiento se debe a la ley de la electrostática:
Signos iguales = se repelen
Signos diferentes = se atraen.
En este caso de que el agua sea pura quiere decir que no va a tener cargas eléctricas.
Este comportamiento se debe a la ley de la electrostática:
Signos iguales = se repelen
Signos diferentes = se atraen.
Suscribirse a:
Entradas (Atom)

